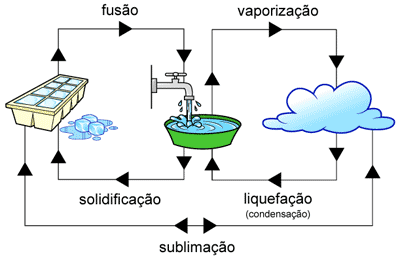
***Os três estados da água**
A água ao contrário de todas as outras substâncias existe nos três estados físicos: no sólido, líquido e gasoso.

E existem nomes próprios para representar este ripo de mudança como a fusão( mudança do estado sólido para líquido), a vaporização( do estado líquido para o gasoso) e sublimação(mudança do estado gasoso para o estado sólido).
* Ponto de Ebulição:
O ponto de ebulição ou temperatura de ebulição é a temperatura em que uma substância passa do estado líquido ao estado gasoso. No ponto de ebulição, a pressão do vapor saturado de um líquido é igual à pressão ambiente (do sistema), a qual pode ser considerada a pressão atmosférica (760 mmHg), caso o sistema esteja comunicante com a atmosfera terrestre e ao nível do mar. Neste último caso, deve-se levar em conta que o ponto de ebulição varia com a altitude, já que a pressão atmosférica varia com a mesma. As ligações químicas que juntam os átomos se "quebram", deixando os átomos muito mais livres (característica do estado gasoso). Quanto mais baixa for a pressão do sistema, menor será o ponto de ebulição e vice-versa. O ponto de ebulição da água em condições de atmosfera padrão é de 100 ºC. Vale citar, como exemplo que, a água, em pressões muito baixas, ferve há temperaturas bem inferiores à 100 ºC.
** Pressão Atmosférica
É a pressão exercida pela atmosfera num determinado ponto. É a força por unidade de área, exercida pelo ar contra uma superfície. Se a força exercida pelo ar aumenta em um determinado ponto, consequentemente a pressão também aumentará. A pressão atmosférica é medida por meio de um equipamento conhecido como barómetro. Essas diferenças de pressão têm uma origem térmica estando directamente relacionadas com a radiação solar e os processos de aquecimento das massas de ar. Formam-se a partir de influências naturais, como: continentalidade, maritimidade, latitude, altitude... As unidades utilizadas são: polegada ou milímetros de mercúrio (mmHg), quilo pascal (kPa), atmosfera (atm), milibar (bar) e hectopascal (hPa), sendo as três últimas, as mais utilizadas no meio científico.
*** Ponto de fusão
O ponto de fusão de um sólido cristalino é a temperatura na qual o sólido começa a se tornar em líquido sob a pressão de uma atmosfera. Um composto orgânico cristalino puro tem um ponto de fusão bem definido com um intervalo menor de 0,5ºC, presença de impurezas imiscíveis ou parcialmente imiscíveis faz com que essa diferença entre a primeira formação do líquido e a fusão total aumente bastante, também causa o início do ponto de fusão a uma temperatura mais baixa. Um composto com alto grau de pureza tem um ponto de fusão bem definido, com excepção de ser uma mistura estética onde dois sólidos passam para do estado sólido paro o estado líquido ao mesmo tempo. O ponto de fusão é usado como critério para avaliar o grau de pureza de um composto, ou ajudar na sua identificação através de comparações com tabelas de pontos de fusão.
**** Métodos para determinação do ponto de fusão
Há vários métodos de determinar o ponto de fusão, entre eles alguns são via experimentos de aquecimentos da solução em banho de aquecimento com substância de ponto de ebulição maior, ou aparelhos de resistência eléctrica equipados com termómetros. Um método comum é o de aquecer uma pequena quantidade de substância que está num tubo capilar, próximo a um termómetro dentro de um banho num líquido que tenha um ponto de ebulição maior que o ponto de fusão da substância.

relaçao entre as estaçoes do ano e as mudanças de estado fisico
ResponderEliminar